人體微生物菌相硏究的新進展
發佈日期:2018-03-12
長庚大學教授 林口長庚醫院主治醫師 王子豪
人體腸道菌相與維護健康和發生疾病息息相關,甚至也能影響到癌症病人對免疫檢查點抑制劑(immune checkpoint inhibitors,又稱checkpoint blockade)的治療反應 (詳見2018-2-26的新知分享)。而最近幾年,腸道菌相影響各種慢性疾病(如第二型糖尿病、肥胖症、和高血壓)的論文,也一直在動物模式與人體硏究中提出。
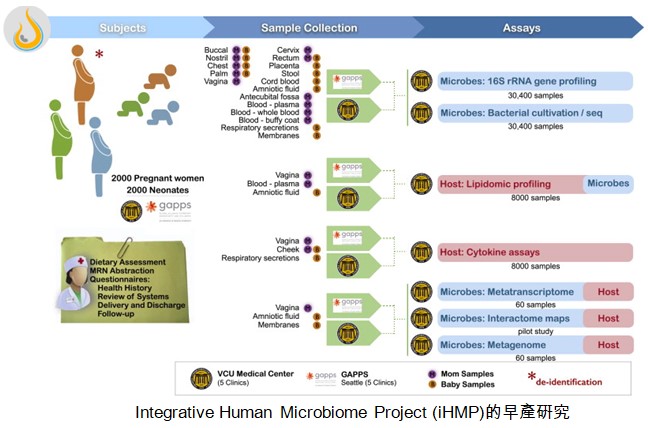
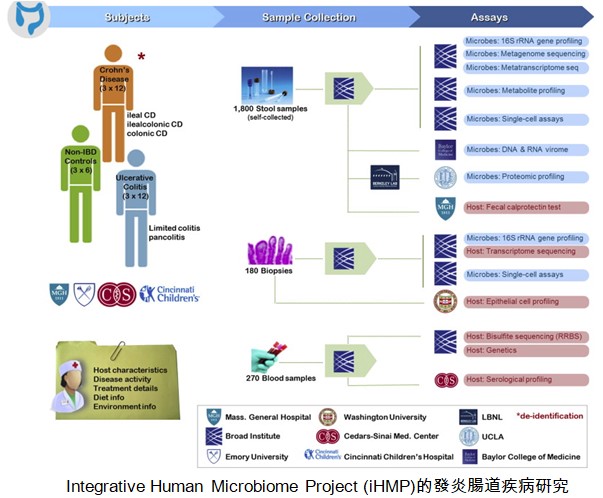
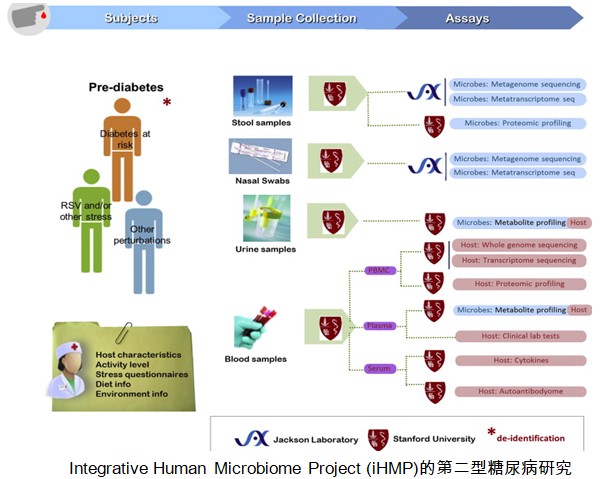
人類基因組計劃(Human Genome Project,HGP)在2003年結束,所獲得的人類DNA序列提供了研究人類健康與疾病的基本藍圖。美國國家健康院(NIH)也於2008年啟動人類微生物組計劃(Human Microbiome Project,HMP),在2013完成第一階段HMP-1 (https://hmpdacc.org/hmp/),共分析了300個健康人的鼻腔、口腔、皮膚、消化道、泌尿生殖道的微生物菌相,不但用16S rRNA定序來鑒定微生物菌相的複雜度,也用混雜全基因組定序(metagenomic whole genome sequencing)來分析這些菌相的可能功能。現在進入第二階段的整合型人類微生物組計劃(integrative HMP, iHMP,https://hmpdacc.org/ihmp/),首先瞄準三個疾病:早產、發炎腸道疾病、第二型糖尿病,其硏究架構見下三圖。
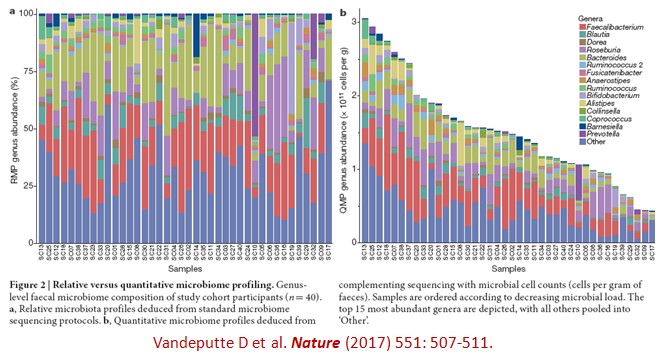
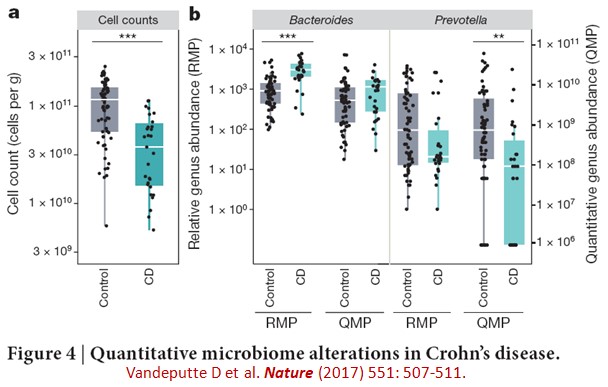
一般研究人體腸道菌相都是分析各種細菌所佔的百分比,而以相對菌相剖析(relative microbiome profiling, RMP)呈現,然而最近比利時學者發表在自然(Nature)的研究,則強調用定量菌相剖析(quantitative microbiome profiling, QMP)分析總菌量(microbial load)的重要性(延伸閱讀一):在40個受試者的糞便菌相分析,除了用16S sRNA定序方式得到各種細菌的比例以外(下圖a),加上用流式細胞儀(flow cytometry)來計數每克糞便的細菌數目,可得到定量菌相剖析(下圖b)。
而在66位健康受試者(control)和29位發炎腸道疾病(Crohn’s disease, CD)的菌相剖析中,發炎腸道疾病的糞便總菌數明顯比健康受試者少(下圖a),定量菌相剖析(QMP)比相對菌相剖析(RMP)更能清楚鑒定出Prevotella細菌數目的減少(下圖b),光是用相對菌相剖析,常會低估CD疾病相關的微生物菌相豐富性的降低。
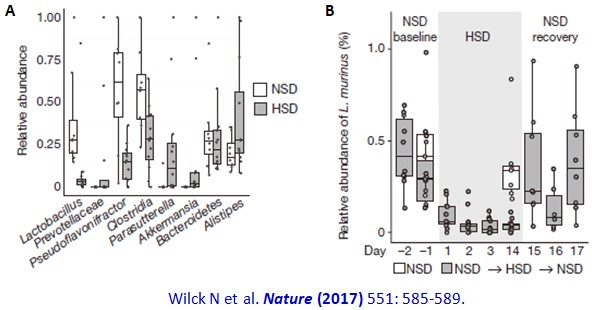
我們一直知道高鹽的飲食和高血壓有關,但最近德國學者領導的跨國研究團隊更進一步發現:高鹽飲食會經由影響腸道菌相來刺激促進發炎反應的TH17淋巴細胞,進而造成自體免疫疾病和高血壓(延伸閱讀二)。首先他們在小鼠模式中顯示,和餵食正常鹽攝取量(normal salt diet, NSD) 的小鼠比較時,餵食高鹽食料(high salt diet, HSD) 的小鼠腸道菌相明顯降低(下圖A),變化最大的是乳酸菌Lactobacillus,在餵食高鹽食料一天就可看到明顯的下降(下圖B)。
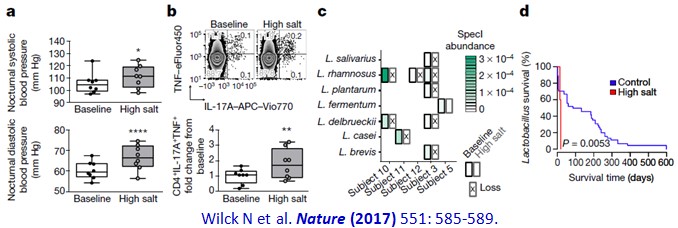
接著,這個團隊對8位健康成年受試者測試:投與高鹽是否也可以看到在小鼠所呈現的變化?在此人體研究中,高鹽(High salt)是在每人的每天基礎飲食量(Baseline)外,加上6克的慢速釋出鹽錠,達到每人每天的平均鹽攝取量為13.8±2.6克。高鹽飲食很明顯的造成血壓上升(下圖a),也刺激促進發炎反應的CD4+IL-17A+TNF+TH17淋巴細胞的產生(下圖b),也很明顯地降低存在於腸道中的各種乳酸菌Lactobacilli (下圖c, d)。
最近幾年,糞便微生物移植(fecal microbiome transplantation)在一些特定疾病能產生特別優異的療效,而這些快速累積的腸道微生物菌相研究報告,正是提供解釋的機制。
延伸閱讀:
- Vandeputte D et al. Quantitative microbiome profiling links gut community variation to microbial load. Nature (2017) 551: 507-511.
- Wilck N et al. Salt-responsive gut commensal modulates TH17 axis and disease. Nature (2017) 551: 585-589.
人體腸道菌相與維護健康和發生疾病息息相關,甚至也能影響到癌症病人對免疫檢查點抑制劑(immune checkpoint inhibitors,又稱checkpoint blockade)的治療反應 (詳見2018-2-26的新知分享)。而最近幾年,腸道菌相影響各種慢性疾病(如第二型糖尿病、肥胖症、和高血壓)的論文,也一直在動物模式與人體硏究中提出。
人類基因組計劃(Human Genome Project,HGP)在2003年結束,所獲得的人類DNA序列提供了研究人類健康與疾病的基本藍圖。美國國家健康院(NIH)也於2008年啟動人類微生物組計劃(Human Microbiome Project,HMP),在2013完成第一階段HMP-1 (https://hmpdacc.org/hmp/),共分析了300個健康人的鼻腔、口腔、皮膚、消化道、泌尿生殖道的微生物菌相,不但用16S rRNA定序來鑒定微生物菌相的複雜度,也用混雜全基因組定序(metagenomic whole genome sequencing)來分析這些菌相的可能功能。現在進入第二階段的整合型人類微生物組計劃(integrative HMP, iHMP,https://hmpdacc.org/ihmp/),首先瞄準三個疾病:早產、發炎腸道疾病、第二型糖尿病,其硏究架構見下三圖。



一般研究人體腸道菌相都是分析各種細菌所佔的百分比,而以相對菌相剖析(relative microbiome profiling, RMP)呈現,然而最近比利時學者發表在自然(Nature)的研究,則強調用定量菌相剖析(quantitative microbiome profiling, QMP)分析總菌量(microbial load)的重要性(延伸閱讀一):在40個受試者的糞便菌相分析,除了用16S sRNA定序方式得到各種細菌的比例以外(下圖a),加上用流式細胞儀(flow cytometry)來計數每克糞便的細菌數目,可得到定量菌相剖析(下圖b)。

而在66位健康受試者(control)和29位發炎腸道疾病(Crohn’s disease, CD)的菌相剖析中,發炎腸道疾病的糞便總菌數明顯比健康受試者少(下圖a),定量菌相剖析(QMP)比相對菌相剖析(RMP)更能清楚鑒定出Prevotella細菌數目的減少(下圖b),光是用相對菌相剖析,常會低估CD疾病相關的微生物菌相豐富性的降低。

我們一直知道高鹽的飲食和高血壓有關,但最近德國學者領導的跨國研究團隊更進一步發現:高鹽飲食會經由影響腸道菌相來刺激促進發炎反應的TH17淋巴細胞,進而造成自體免疫疾病和高血壓(延伸閱讀二)。首先他們在小鼠模式中顯示,和餵食正常鹽攝取量(normal salt diet, NSD) 的小鼠比較時,餵食高鹽食料(high salt diet, HSD) 的小鼠腸道菌相明顯降低(下圖A),變化最大的是乳酸菌Lactobacillus,在餵食高鹽食料一天就可看到明顯的下降(下圖B)。

接著,這個團隊對8位健康成年受試者測試:投與高鹽是否也可以看到在小鼠所呈現的變化?在此人體研究中,高鹽(High salt)是在每人的每天基礎飲食量(Baseline)外,加上6克的慢速釋出鹽錠,達到每人每天的平均鹽攝取量為13.8±2.6克。高鹽飲食很明顯的造成血壓上升(下圖a),也刺激促進發炎反應的CD4+IL-17A+TNF+TH17淋巴細胞的產生(下圖b),也很明顯地降低存在於腸道中的各種乳酸菌Lactobacilli (下圖c, d)。

最近幾年,糞便微生物移植(fecal microbiome transplantation)在一些特定疾病能產生特別優異的療效,而這些快速累積的腸道微生物菌相研究報告,正是提供解釋的機制。
延伸閱讀:
- Vandeputte D et al. Quantitative microbiome profiling links gut community variation to microbial load. Nature (2017) 551: 507-511.
- Wilck N et al. Salt-responsive gut commensal modulates TH17 axis and disease. Nature (2017) 551: 585-589.

