腸道微生物叢基因體影響癌症病人對免疫治療的反應
發佈日期:2018-02-26
長庚大學教授 林口長庚醫院主治醫師 王子豪
每個人身上的微生物(microbes)重量約有1300到1400克,大約和人腦等重量。一個人身上的各種微生物總稱為人體微生物叢(human microbiota),而這些微生物的基因總稱為人體微生物叢基因體(human microbiome) 。每個人的人體微生物叢的總數目(1014)是一個成年人自己細胞數目(1013)的10倍;而人體微生物叢基因體的基因數(兩百萬~兩千萬)更是人類基因數目(約兩萬基因)的100~1000倍。從細胞數目來看,每個人只有10%的細胞是屬於人類細胞;從基因數目來看,則頂多只有1%的基因是屬於人類基因。所以,每個人(好比一棟大樓)都是人類細胞(房東)和人體微生物叢(房客)的一個生態系統。從這個角度來看,一個人的獨特性-意即人與人之間的差別,是由身上的微生物菌叢來決定,而非人類基因序列的差別。因為,兩人之間的人類基因序列只有<0.1%的差異,而人體微生物叢基因體卻有>90%的差異。
微生物可以分成四類:細菌(bacteria)、古細菌(archea)、病毒(viruses)、和真核微生物(microeukaryotes)。人體微生物叢對維持健康和疾病發生的重要性,最近越來越受到矚目,但因為混雜基因體學(metagenomics)還是一個新興的學門,現在研究人體微生物叢的對象,大都還只針對細菌而言。即便這樣,最近(2018)發表於Science的文獻更發現:人類腸道菌相甚至也影響癌症病人對免疫檢查點抑制劑(immune checkpoint inhibitors, 又稱checkpoint blockade)治療的反應。
在2015年分別有兩個團隊在Science期刊發表(延伸閱讀1和2):小鼠的腸道菌相會影響使用檢查點抑制劑的癌症免疫療效,使用抗生素破壞了腸道菌相會降低免疫治療效果;反之,使用糞便移植重建腸道菌相可改善癌症免疫療效。雖然確實的機制仍不清楚,但猜測腸道菌相能促進樹突細胞強化T細胞對免疫檢查點抑制劑的反應(下圖)。
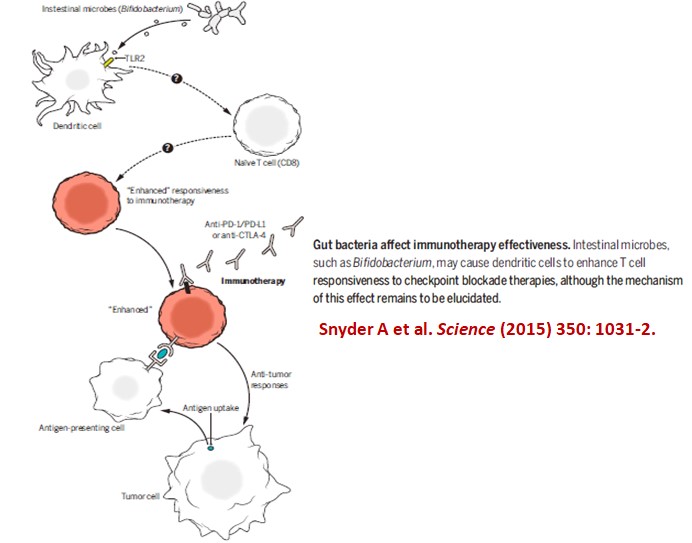
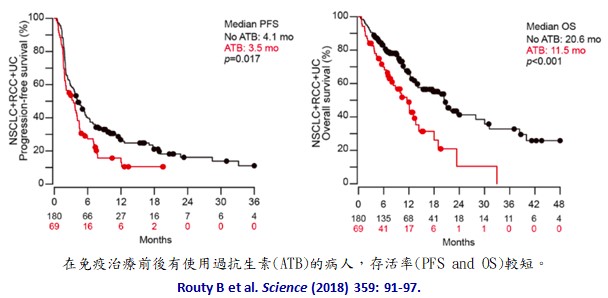
在2018年,一個法國、美國、瑞典的跨國團隊(延伸閱讀3) 研究接受免疫檢查點抑制劑治療的140個肺癌、67個腎癌和42個膀胱癌病人,在這 249位病人中,有69位病人(28%)在免疫治療前兩個月內或治療後一個月內曾接受抗生素(ATB)治療,結果接受抗生素治療的病人,不管是無進展存活率(progression-free survival, PFS)或綜合存活率(overall survival, OS)都較低 (下圖)。從病人糞便的複雜基因體學研究發現:對anti-PD-1免疫治療反應較好的病人糞便中含有較多的 Akkermansia muciniphila細菌。
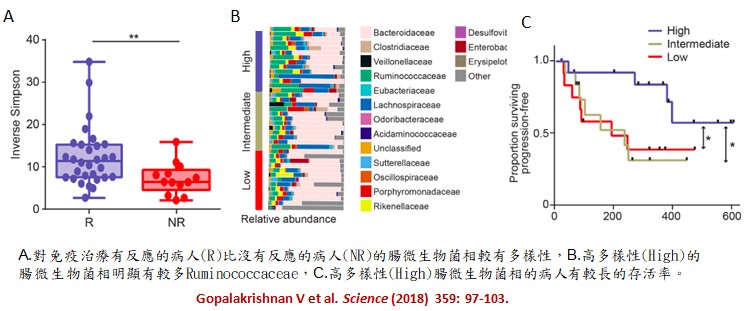
另一個美國德州MD Anderson Cancer Center的研究團隊(延伸閱讀4),分析112名接受anti-PD-1免疫治療的轉移性黑色素瘤病人的口腔和腸道的微生物叢基因體,結果發現:口腔菌相和治療無反應(NR, n=32)或有治療反應(R, n=54)無相關;但是,和治療無反應(NR, n=13) 的病人比較時,有治療反應(R, n=30) 的病人的腸道菌相多樣性高(下圖A)且含較多Ruminococcaceae菌(下圖B);而且腸道菌相多樣性高的病人明顯有較長的存活率(下圖C)。
有趣的是,Akkermansia muciniphila細菌曾經被發現和肥胖有負相關,而被媒體渲染成減肥明星細菌;而Ruminococcaceae菌也被報告和肥胖有負相關。
延伸閱讀:
- Sivan A et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science (2015) 350: 1084-9.
- Vetizou M et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science (2015) 350: 1079-84.
- Routy B et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science (2018) 359: 91-97.
- Gopalakrishnan V et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science (2018) 359: 97-103.
每個人身上的微生物(microbes)重量約有1300到1400克,大約和人腦等重量。一個人身上的各種微生物總稱為人體微生物叢(human microbiota),而這些微生物的基因總稱為人體微生物叢基因體(human microbiome) 。每個人的人體微生物叢的總數目(1014)是一個成年人自己細胞數目(1013)的10倍;而人體微生物叢基因體的基因數(兩百萬~兩千萬)更是人類基因數目(約兩萬基因)的100~1000倍。從細胞數目來看,每個人只有10%的細胞是屬於人類細胞;從基因數目來看,則頂多只有1%的基因是屬於人類基因。所以,每個人(好比一棟大樓)都是人類細胞(房東)和人體微生物叢(房客)的一個生態系統。從這個角度來看,一個人的獨特性-意即人與人之間的差別,是由身上的微生物菌叢來決定,而非人類基因序列的差別。因為,兩人之間的人類基因序列只有<0.1%的差異,而人體微生物叢基因體卻有>90%的差異。
微生物可以分成四類:細菌(bacteria)、古細菌(archea)、病毒(viruses)、和真核微生物(microeukaryotes)。人體微生物叢對維持健康和疾病發生的重要性,最近越來越受到矚目,但因為混雜基因體學(metagenomics)還是一個新興的學門,現在研究人體微生物叢的對象,大都還只針對細菌而言。即便這樣,最近(2018)發表於Science的文獻更發現:人類腸道菌相甚至也影響癌症病人對免疫檢查點抑制劑(immune checkpoint inhibitors, 又稱checkpoint blockade)治療的反應。
在2015年分別有兩個團隊在Science期刊發表(延伸閱讀1和2):小鼠的腸道菌相會影響使用檢查點抑制劑的癌症免疫療效,使用抗生素破壞了腸道菌相會降低免疫治療效果;反之,使用糞便移植重建腸道菌相可改善癌症免疫療效。雖然確實的機制仍不清楚,但猜測腸道菌相能促進樹突細胞強化T細胞對免疫檢查點抑制劑的反應(下圖)。

在2018年,一個法國、美國、瑞典的跨國團隊(延伸閱讀3) 研究接受免疫檢查點抑制劑治療的140個肺癌、67個腎癌和42個膀胱癌病人,在這 249位病人中,有69位病人(28%)在免疫治療前兩個月內或治療後一個月內曾接受抗生素(ATB)治療,結果接受抗生素治療的病人,不管是無進展存活率(progression-free survival, PFS)或綜合存活率(overall survival, OS)都較低 (下圖)。從病人糞便的複雜基因體學研究發現:對anti-PD-1免疫治療反應較好的病人糞便中含有較多的 Akkermansia muciniphila細菌。

另一個美國德州MD Anderson Cancer Center的研究團隊(延伸閱讀4),分析112名接受anti-PD-1免疫治療的轉移性黑色素瘤病人的口腔和腸道的微生物叢基因體,結果發現:口腔菌相和治療無反應(NR, n=32)或有治療反應(R, n=54)無相關;但是,和治療無反應(NR, n=13) 的病人比較時,有治療反應(R, n=30) 的病人的腸道菌相多樣性高(下圖A)且含較多Ruminococcaceae菌(下圖B);而且腸道菌相多樣性高的病人明顯有較長的存活率(下圖C)。

有趣的是,Akkermansia muciniphila細菌曾經被發現和肥胖有負相關,而被媒體渲染成減肥明星細菌;而Ruminococcaceae菌也被報告和肥胖有負相關。
延伸閱讀:
- Sivan A et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science (2015) 350: 1084-9.
- Vetizou M et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science (2015) 350: 1079-84.
- Routy B et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science (2018) 359: 91-97.
- Gopalakrishnan V et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science (2018) 359: 97-103.

