癌症精準治療-偵測同源重組基因修復能力的新進展
發佈日期:2018-02-26
國立臺灣大學 生化科學研究所 冀宏源教授
在癌症傳統化療中,化療藥物除了殺死癌細胞外,也會造成不同程度正常細胞的傷害,進而引起令患者不適的副作用,如嘔吐及掉髮等症狀。因此如何提高用藥的精準度,增進治療的效果及患者的生活品質是非常重要的議題。近年來,鑑定出癌細胞在不同的基因組背景下,會對特定藥物有特異性的反應,可有助於療效及降低副作用。例如乳癌或卵巢癌的癌細胞若帶有BRCA1或是BRCA2基因的突變,則對PARP (Poly (ADP-Ribose) Polymerase)的抑制劑,如奧拉帕尼 (olaparib) 有很好的治療反應。
BRCA1和BRCA2基因在細胞內的重要生化功能,主要作為受損DNA的修復蛋白。細胞的基因組DNA無時無刻都會受到損傷,這些來源可能來自細胞內的自由基的攻擊,或者是遭受外在環境,如紫外線和致癌物質。其中,DNA的雙股斷裂最為嚴重,若無法有效的修復完全,會造成細胞基因組的不穩定性,進而引起細則胞的死亡。因此,細胞必須具有完善的DNA雙股斷裂修復系統,來確保基因組的完整,而同源重組 (Homologous Recombination) 即為其中最重要及精準的DNA修復系統之一。
源重組所進行的DNA雙股斷裂修復系統,為一連串修復蛋白質和DNA交互作用的修復反應。在整個過程中,RAD51修復酵素必需和受損DNA處的單股DNA做結合,接下來找尋同源的雙股DNA做為模版,進行DNA的互換並補回缺失的DNA。而在RAD51所進行的生化反應中,BRCA1和BRCA2蛋白為協助RAD51和DNA結合,並催化修復反應進行,所不可或缺的 (圖一)。而這些對同源重組修復機制上的基礎研究了解,促使了進一步的研發及應用到癌症個人化的精準化療。
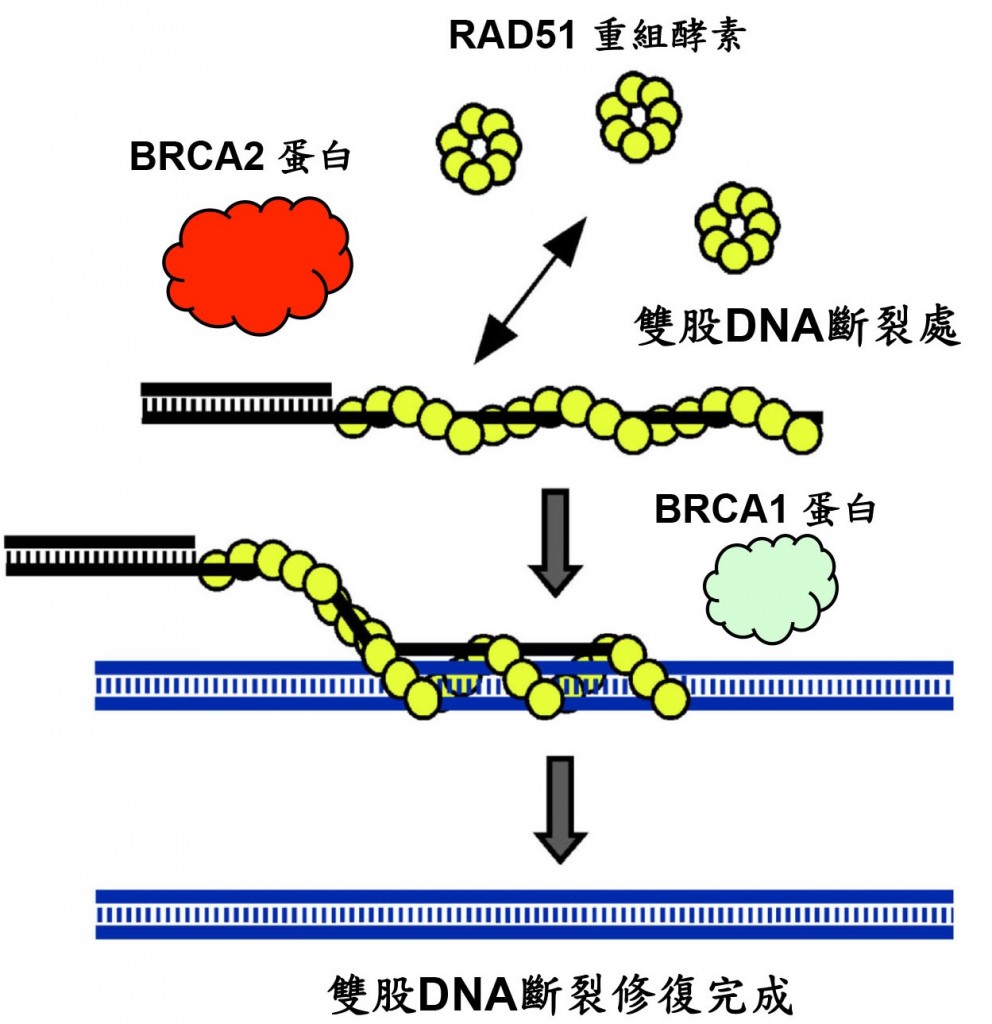
圖一、BRCA1和BRCA2蛋白主要的生化功能為協助RAD51重組酵素能有效的進行催化反應,將受損雙股斷裂的DNA能正確無誤的修復完成,以維持細胞基因組的完整和穩定性。
我們可以想像細胞像一張三隻腳的桌子,這三隻腳就分別代表三大DNA修復系統,來修復各式各樣的DNA損傷,以維持細胞能不斷的分裂增生。若某些癌細胞的其中一套DNA修復系統如同源重組修復反應失調,則如同斷了一隻腳的桌子,必須完全依賴另外二隻腳的DNA修復系統來撐起癌細胞的存活,若此時給予藥物如奧拉帕尼特異的破壞另一隻腳,則此時剩下一隻腳的桌子無法站立而倒下,即癌細胞死亡,這個現象稱為合成致死性(synthetic lethality)。相反的,正常細胞只有一隻腳受損,另外二隻腳足以維持細胞生存 (圖二)。如此,利用癌細胞其同源重組修復系統的缺失,我們可以特異的殺死癌細胞而非正常細胞,以達到精準的治療效果並降低副作用的個人醫療。由於臨床實驗研究的成功,目前美國食品藥品管理局也針對乳癌及卵巢癌的病患,准予屬於同源重組修復反應失調的癌症病患,可以給予奧拉帕尼用以維持性的治療。

圖二、奧拉帕尼 (olaparib) 針對同源重組DNA修復能力缺失的癌細胞,例如BRCA1和BRCA2基因突變的癌細胞,具有很好的治療反應。
由上述可知,診斷癌細胞的同源重組修復能力的好壞,為精準用藥的重要判斷依據。至目前為止,已有許多不同偵測癌細胞同源重組修復能力的方法。在細胞層次上,科學家可藉由放射線照射癌細胞檢體,並搭配RAD51抗體免疫螢光染色法,來確認是否可偵測到DNA雙股斷裂損傷所誘導的RAD51蛋白在損傷處聚集;而RAD51蛋白的聚集需要BRCA2的協助;因此,缺乏RAD51聚集可代表BRCA2的功能喪失,也就是細胞缺乏同源重組修復能力。而近幾年因DNA定序技術的突破及快速發展,科學家可直接定序細胞BRCA1、BRCA2、及已知參與同源重組相關基因是否有缺失及突變,來做為同源重組修復能力是否完好的判斷。
除了直接定序同源重組相關基因,或者是鑑定這些基因轉錄的啟動子 (promoter) 是否有甲基化而抑制基因的表達量外,最近科學家利用大量的定序癌細胞整個基因組並結合數學演算的程式,發現在“BRCAness”即同源重組修復能力缺失的細胞,常會在這些基因組有特定的DNA突變模式,例如:有重覆性小片斷DNA序列的排列等。利用癌細胞基因組因同源重組失調而具有如此特異的突變模式做為標誌,科學家新建立了一套演算法稱為“HRDetect”,並證明了將基因組定序的結果,藉由HRDetect的演算評估,可以有效的診斷出此癌細胞的同源重組能力的好壞。在最近發表的論文中,以HRDetect來分析560個臨床乳癌病人的癌細胞,發現有近20%的乳癌細胞缺乏同源重組修復能力;而且更值得注意的是,其中47個案例雖然其 BRCA1 和 BRCA2的基因定序是正常的,但仍是同源重組反應缺失的細胞。這項新的研究發現令我們思考二件事:第一、同源重組修復能力缺失的癌細胞比之前想像來得多,而這些病患可適用於奧拉帕尼來達到個人客制化的精準醫療;第二、HRDetect的演算偵測方式能與現在直接定序同源重組相關基因的方法互補,而這些診斷癌細胞同源重組能力方法的突破,使醫師能更精確偵測出同源重組缺失的癌細胞,而給予精準的治療。
延伸閱讀:
- Davies, H. et al. HRDetect is a predictor of BRCA1 and BRCA2 deficiency based on mutational signatures. Nature Medicine (2017) 23:517-525.
- Leslie, M. Analysis suggests wider use for PARP inhibitors. Cancer Discovery (2017) 7:OF7.
- Zhao, W. et al. BRCA1-BARD1 promotes RAD51-mediated homologous DNA pairing. Nature (2017) 550:360-365.
- Zhao, W. et al. Promotion of BRCA2-Dependent Homologous Recombination by DSS1 via RPA Targeting and DNA Mimicry. Molecular Cell (2015) 59:176-87.
- Chao, A. et al. Prevalence and clinical significance of BRCA1/2 germline and somatic mutations in Taiwanese patients with ovarian cancer. Oncotarget (2016) 7:85529-85541.
- Su, G.C. et al. Role of the RAD51-SWI5-SFR1 Ensemble in homologous recombination. Nucleic Acids Research (2016) 44:6242-51.
- Prakash, R. et al. Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins. Cold Spring Harb Perspect Biol. (2015) 7:a016600.
在癌症傳統化療中,化療藥物除了殺死癌細胞外,也會造成不同程度正常細胞的傷害,進而引起令患者不適的副作用,如嘔吐及掉髮等症狀。因此如何提高用藥的精準度,增進治療的效果及患者的生活品質是非常重要的議題。近年來,鑑定出癌細胞在不同的基因組背景下,會對特定藥物有特異性的反應,可有助於療效及降低副作用。例如乳癌或卵巢癌的癌細胞若帶有BRCA1或是BRCA2基因的突變,則對PARP (Poly (ADP-Ribose) Polymerase)的抑制劑,如奧拉帕尼 (olaparib) 有很好的治療反應。
BRCA1和BRCA2基因在細胞內的重要生化功能,主要作為受損DNA的修復蛋白。細胞的基因組DNA無時無刻都會受到損傷,這些來源可能來自細胞內的自由基的攻擊,或者是遭受外在環境,如紫外線和致癌物質。其中,DNA的雙股斷裂最為嚴重,若無法有效的修復完全,會造成細胞基因組的不穩定性,進而引起細則胞的死亡。因此,細胞必須具有完善的DNA雙股斷裂修復系統,來確保基因組的完整,而同源重組 (Homologous Recombination) 即為其中最重要及精準的DNA修復系統之一。
源重組所進行的DNA雙股斷裂修復系統,為一連串修復蛋白質和DNA交互作用的修復反應。在整個過程中,RAD51修復酵素必需和受損DNA處的單股DNA做結合,接下來找尋同源的雙股DNA做為模版,進行DNA的互換並補回缺失的DNA。而在RAD51所進行的生化反應中,BRCA1和BRCA2蛋白為協助RAD51和DNA結合,並催化修復反應進行,所不可或缺的 (圖一)。而這些對同源重組修復機制上的基礎研究了解,促使了進一步的研發及應用到癌症個人化的精準化療。

圖一、BRCA1和BRCA2蛋白主要的生化功能為協助RAD51重組酵素能有效的進行催化反應,將受損雙股斷裂的DNA能正確無誤的修復完成,以維持細胞基因組的完整和穩定性。
我們可以想像細胞像一張三隻腳的桌子,這三隻腳就分別代表三大DNA修復系統,來修復各式各樣的DNA損傷,以維持細胞能不斷的分裂增生。若某些癌細胞的其中一套DNA修復系統如同源重組修復反應失調,則如同斷了一隻腳的桌子,必須完全依賴另外二隻腳的DNA修復系統來撐起癌細胞的存活,若此時給予藥物如奧拉帕尼特異的破壞另一隻腳,則此時剩下一隻腳的桌子無法站立而倒下,即癌細胞死亡,這個現象稱為合成致死性(synthetic lethality)。相反的,正常細胞只有一隻腳受損,另外二隻腳足以維持細胞生存 (圖二)。如此,利用癌細胞其同源重組修復系統的缺失,我們可以特異的殺死癌細胞而非正常細胞,以達到精準的治療效果並降低副作用的個人醫療。由於臨床實驗研究的成功,目前美國食品藥品管理局也針對乳癌及卵巢癌的病患,准予屬於同源重組修復反應失調的癌症病患,可以給予奧拉帕尼用以維持性的治療。

圖二、奧拉帕尼 (olaparib) 針對同源重組DNA修復能力缺失的癌細胞,例如BRCA1和BRCA2基因突變的癌細胞,具有很好的治療反應。
由上述可知,診斷癌細胞的同源重組修復能力的好壞,為精準用藥的重要判斷依據。至目前為止,已有許多不同偵測癌細胞同源重組修復能力的方法。在細胞層次上,科學家可藉由放射線照射癌細胞檢體,並搭配RAD51抗體免疫螢光染色法,來確認是否可偵測到DNA雙股斷裂損傷所誘導的RAD51蛋白在損傷處聚集;而RAD51蛋白的聚集需要BRCA2的協助;因此,缺乏RAD51聚集可代表BRCA2的功能喪失,也就是細胞缺乏同源重組修復能力。而近幾年因DNA定序技術的突破及快速發展,科學家可直接定序細胞BRCA1、BRCA2、及已知參與同源重組相關基因是否有缺失及突變,來做為同源重組修復能力是否完好的判斷。
除了直接定序同源重組相關基因,或者是鑑定這些基因轉錄的啟動子 (promoter) 是否有甲基化而抑制基因的表達量外,最近科學家利用大量的定序癌細胞整個基因組並結合數學演算的程式,發現在“BRCAness”即同源重組修復能力缺失的細胞,常會在這些基因組有特定的DNA突變模式,例如:有重覆性小片斷DNA序列的排列等。利用癌細胞基因組因同源重組失調而具有如此特異的突變模式做為標誌,科學家新建立了一套演算法稱為“HRDetect”,並證明了將基因組定序的結果,藉由HRDetect的演算評估,可以有效的診斷出此癌細胞的同源重組能力的好壞。在最近發表的論文中,以HRDetect來分析560個臨床乳癌病人的癌細胞,發現有近20%的乳癌細胞缺乏同源重組修復能力;而且更值得注意的是,其中47個案例雖然其 BRCA1 和 BRCA2的基因定序是正常的,但仍是同源重組反應缺失的細胞。這項新的研究發現令我們思考二件事:第一、同源重組修復能力缺失的癌細胞比之前想像來得多,而這些病患可適用於奧拉帕尼來達到個人客制化的精準醫療;第二、HRDetect的演算偵測方式能與現在直接定序同源重組相關基因的方法互補,而這些診斷癌細胞同源重組能力方法的突破,使醫師能更精確偵測出同源重組缺失的癌細胞,而給予精準的治療。
延伸閱讀:
- Davies, H. et al. HRDetect is a predictor of BRCA1 and BRCA2 deficiency based on mutational signatures. Nature Medicine (2017) 23:517-525.
- Leslie, M. Analysis suggests wider use for PARP inhibitors. Cancer Discovery (2017) 7:OF7.
- Zhao, W. et al. BRCA1-BARD1 promotes RAD51-mediated homologous DNA pairing. Nature (2017) 550:360-365.
- Zhao, W. et al. Promotion of BRCA2-Dependent Homologous Recombination by DSS1 via RPA Targeting and DNA Mimicry. Molecular Cell (2015) 59:176-87.
- Chao, A. et al. Prevalence and clinical significance of BRCA1/2 germline and somatic mutations in Taiwanese patients with ovarian cancer. Oncotarget (2016) 7:85529-85541.
- Su, G.C. et al. Role of the RAD51-SWI5-SFR1 Ensemble in homologous recombination. Nucleic Acids Research (2016) 44:6242-51.
- Prakash, R. et al. Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins. Cold Spring Harb Perspect Biol. (2015) 7:a016600.

